Gabriela Pérez
Incluso en las desoladas tierras baldías del espacio interestelar, las moléculas orgánicas complejas parecen encontrar la manera de formarse.
Está a cientos de años luz de la Tierra, es fría y oscura. Las estrellas emergentes que existen son en su mayoría demasiado jóvenes y muy pocas para tener mucho impacto en temperaturas que oscilan entre 373.15 y sólo 283.15 ºC. La densidad de las partículas puede ser miles de billones de veces menor que la de un gas en la Tierra. Es bastante razonable que durante mucho tiempo la gente supusiera que no pasaba gran cosa en este espacio oscuro y vacío entre las estrellas.
Pero gracias a los avances en la tecnología astronómica, ahora sabemos que se trata de regiones en constante evolución donde las densidades de materia cambian, las nubes atómicas se transforman en nubes moleculares que colapsan bajo la gravedad dando lugar a protoestrellas. Se han detectado más de 260 especies moleculares diferentes en el espacio interestelar, incluidos alcoholes, aldehídos, ácidos y amidas y muchas otras moléculas orgánicas, algunas familiares en la Tierra, otras no estables en absoluto aquí.
“Somos capaces de encontrar e identificar con absoluta certeza algunas de las moléculas que están presentes no sólo en la Tierra, no sólo en las nebulosas gaseosas en las proximidades del Sol, sino también en las nubes moleculares de las galaxias más distantes que pertenecen a un universo joven en el borde del universo“, explica Michel Guelin, astrónomo del Instituto de Radioastronomía Milimétrica de Grenoble, Francia.

La conclusión general es que la composición química de la materia es la misma aquí y en el otro extremo del universo, y la química basada en el carbono, al menos hasta la etapa de las moléculas prebióticas, parece dominar. Si bien esto elimina parte del misterio de lo que podría haber ahí afuera. Investigadores de todo el mundo ahora están tratando de comprender cómo todas estas moléculas orgánicas tan a menudo asociadas con el ambiente cálido y activo de los organismos vivos pueden formarse en algún lugar tan frío, oscuro y vacío, el tipo de lugar donde se podría esperar que la química orgánica muriera.
Un grano de esperanza para la química interestelar
Dado que el hidrógeno es el elemento más abundante en el universo y forma una molécula tan simple de sólo dos átomos de hidrógeno, podría parecer la molécula más obvia a buscar en una nube molecular. Sin embargo, aunque se han observado señales del hidrógeno molecular, resulta que su formación en el espacio interestelar no es tan sencilla.

La energía liberada en la reacción de dos átomos de hidrógeno para producir una molécula de hidrógeno en fase gaseosa desgarraría la nueva molécula. Puede formarse gracias a la existencia de granos de polvo, que pueblan las nubes moleculares con una abundancia de alrededor de uno a cien en comparación con las partículas de gas.
Estos granos generalmente tienen una superficie de agua sólida amorfa ya que allí las moléculas de agua se acumulan una a una, ya sea formándose a partir de oxígeno e hidrógeno en el grano o adhiriéndose ya formadas. Sería necesario calentarlos muy por encima de las temperaturas locales de 10 a 100 K (Recuerda que 1K equivale a 273.15 ºC ) para que el agua sólida forme el hielo cristalino que conocemos en la Tierra.
Tales granos de polvo pueden disipar la energía de la reacción cuando se forma una molécula de hidrógeno, dejando la nueva molécula intacta. «La disipación de energía es muy importante porque permite que se puedan llevar a cabo procesos de adición sencillos», explica Masashi Tsuge, que estudia ciencias de las bajas temperaturas en la Universidad de Hokkaido, Japón.
Estas reacciones de adición son particularmente importantes entre radicales libres como CH2 OH o CH3 O, que podrían combinarse para dar metoximetanol CH3 OCH2 OH. Sin estos granos de polvo, los esfuerzos por explicar el origen de los cientos de moléculas diferentes observadas en el espacio interestelar a partir de una química puramente en fase gaseosa se quedan cortos por un amplio margen.

Túneles hacia el agua
Sin embargo, la presencia de esta agua presenta otro enigma, porque la barrera de energía de activación que debe superarse para que se formen moléculas de agua es mucho más alta que las energías a las temperaturas heladas de una nube molecular. Resulta que, si bien el agua es la molécula más abundante en estos granos de polvo, sólo se forma gracias al túnel cuántico, un efecto mecánico cuántico que permite una probabilidad pequeña pero finita de que algo suceda, incluso cuando la energía requerida según la física clásica no es suficiente.
El papel de los túneles cuánticos en la química se puede identificar en experimentos observando las reacciones a medida que disminuye la temperatura. Para la química térmica convencional, la velocidad disminuirá gradualmente a medida que la temperatura disminuya y haya menos energía disponible para la reacción.
Sin embargo, la probabilidad de formación de túneles depende sólo de la distancia y el tamaño de las partículas, por lo que a medida que las temperaturas disminuyen a un nivel en el que los efectos cuánticos comienzan a ser significativos, la velocidad de reacción se estabiliza.
Esta es también la razón por la que, aunque la proporción de la velocidad de reacción térmica del hidrógeno es aproximadamente 1,4 veces mayor que la del deuterio, la velocidad de la reacción de túnel cuántico sería cien o incluso mil veces más rápida porque el deuterio tiene el doble de masa que el hidrógeno. Como resultado, comparar las velocidades de reacción con deuterio en lugar de hidrógeno puede ser un indicador útil de si la tunelización cuántica está involucrada en la reacción.
Otras pruebas del papel de los túneles cuánticos en la química también provienen de reacciones que se han observado experimentalmente a temperaturas que se sabe que son demasiado bajas para superar lo que se ha calculado que es la barrera a la reacción, como la hidrogenación del monóxido de carbono. Así, algunas de las otras moléculas más abundantes en los granos de hielo, incluidos el formaldehído y el metanol, también deben su existencia a la tunelización cuántica.

Surfeando la superficie
El inusual estado sólido pero amorfo del agua en la superficie del grano tiene un impacto en otro papel crítico que desempeñan los granos de hielo en la química interestelar. A medida que los reactivos se adsorben y permanecen en la superficie del grano, el tiempo de interacción se prolonga, lo que permite más tiempo para las reacciones químicas, pero muchas de ellas requerirían un nivel de movilidad en la superficie del grano para que los átomos puedan difundirse hacia otros átomos donde podrían reaccionar. La naturaleza de la superficie del grano y cómo el átomo se adhiere a ella tiene un impacto crítico en lo que puede hacer allí.
Ha quedado claro que el hidrógeno puede difundirse en la superficie de este tipo de granos de polvo incluso a las bajas temperaturas del espacio interestelar porque los átomos de hidrógeno son muy pequeños y están débilmente unidos al hielo. Sin embargo, la química para crear todas las moléculas orgánicas que se han observado en el medio interestelar gira en torno a reacciones con átomos de carbono.
Al principio se pensaba que los átomos de carbono podían moverse sobre la superficie del grano a bajas temperaturas. Luego, cálculos posteriores sobre cómo se adheriría el carbono a la superficie del agua sólida amorfa sugirieron que la longitud y la fuerza del enlace serían similares a las de un enlace covalente.

Esencialmente, el átomo de carbono sería quimiosorbido inmediatamente, dejando poco margen de maniobra a través de la difusión superficial a las temperaturas del espacio interestelar, por lo que sólo podría reaccionar con otro átomo de carbono allí si la quimisorción inicial los colocara uno al lado del otro. Por lo tanto, las posibilidades de que se produzca gran parte de la química del carbono en los granos de polvo parecerían bastante escasas, si la evidencia es sólida. contra la difusión superficial del carbono fueron concluyentes.
“El problema es que ambos escenarios se escribieron sin elucidación experimental”, dice Tsuge a Chemistry World. Para resolver el debate, él y sus colegas combinaron la desorción fotoestimulada con la ionización multifotónica mejorada por resonancia, una técnica que ya había demostrado ser útil para estudiar la difusión de moléculas de OH en granos de hielo.
Depositaron moléculas de agua sobre aluminio ultrafrío para producir la superficie amorfa del hielo y luego agregaron algunos átomos de carbono, los estimularon con un láser cuidadosamente sintonizado para desorberlos y luego los ionizaron para que pudieran ser detectados con un espectrómetro de masas. Cualquier átomo de carbono que difunda y se una a otro no aparecerá en el censo de espectrometría de masas porque la longitud de onda para la ionización está ajustada de modo que solo se ionicen átomos de carbono individuales. Sus experimentos demostraron que el carbono puede difundirse en las superficies de los granos de polvo.
Los grandes conglomerados moleculares
Con las reacciones aditivas y la química del carbono en juego, es posible intentar describir la procedencia de algunas de las moléculas más complejas observadas en el espacio interestelar, como las descubiertas en una nube molecular en la constelación de Tauro conocida como TMC-1.
Por un lado, la desolación del espacio interestelar altera significativamente la estabilidad de las moléculas, haciéndolas menos propensas a romperse, ya que se encuentran condiciones muy singulares y muy pocas posibilidades de reaccionar. Por eso, cuando se forman moléculas que se consideran inestables en la Tierra, pueden sobrevivir durante mucho tiempo.
Los ejemplos incluyen HCO+, nitrógeno protonado N2 H+, CCH, C3 N y C4 H. Sin embargo, incluso en comparación con el espacio interestelar, TMC -1 está particularmente desprovisto de la energía y la materia en las que prospera la química. Sin embargo, dos estudios en particular (Gotham y Quijote, que utilizan el telescopio Green Bank de 100 m y el telescopio Yebes de 40 m) han permitido el descubrimiento de todo tipo de moléculas de carbono cíclicas y de cadena larga allí, gracias a los grandes tamaños de los platos y al amplio ancho de banda de menor ruido. Receptores que permiten sensibilidades impresionantes en radiofrecuencias.

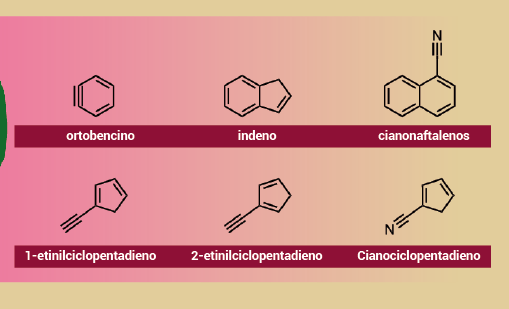
Entre los descubrimientos recientes en TMC-1 en los últimos años se encuentran varias moléculas cíclicas basadas en carbono: ortobencino (C6H4), cianonaftalenos y moléculas con anillos de cinco miembros, como el indeno (C9H8) y ciclopentadienos.
Una forma de explicar cómo se forman estas moléculas más complejas es mediante la ruptura de moléculas aún más grandes producidas alrededor de una estrella caliente: síntesis “de arriba hacia abajo”.
Sin embargo, Christopher Shingledecker, astrofísico molecular teórico/computacional del Benedictine College de EE. UU., explica que si bien se ha descubierto que las atmósferas de estrellas antiguas, ricas en carbono, de masa baja a media, tienen inventarios químicos bastante ricos, incluido benceno, la observación de moléculas incluso tan complejas como los hidrocarburos aromáticos policíclicos en nubes moleculares frías son más difíciles de explicar desde un mecanismo de arriba hacia abajo: moléculas tan grandes deberían haberse fotodisociado antes de poder llegar a una nube molecular fría.
Como resultado, un número cada vez mayor de expertos favorece una versión “de abajo hacia arriba” de los acontecimientos, en la que se forman moléculas complejas en nubes moleculares a partir de la combinación de precursores más pequeños. La pregunta entonces es cuáles son sus precursores.
“Las reacciones en fase gaseosa en el espacio son como una secuencia de colisiones bimoleculares”, señala Ralf Kaiser, profesor del departamento de química de la Universidad de Hawaii (EE.UU.). Con tan poco alrededor, las posibilidades de que más de dos partículas colisionen en la fase gaseosa se vuelven extremadamente raras, incluso en escalas de tiempo astronómicas, por lo que el desafío es encontrar dos posibles precursores de la molécula en cuestión para intentar identificarlos. por la química interestelar.

Los cálculos que han intentado demostrar cómo los hidrocarburos aromáticos policíclicos sustituidos como el fulvenaleno (C7H6) 1- y 2-etinilciclopentadieno (1ECP y 2ECP) podrían formarse a partir de precursores de benceno y fenilo arrojan abundancias significativamente inferiores a las observadas.
Sin embargo, una explicación más probable para la procedencia de estas complejas moléculas aromáticas puede ser la de los radicales metilo (CH3) que también se han observado en el espacio interestelar en el centro galáctico Sagitario A* y el ortobencino. Shingledecker, en colaboración con investigadores de EE. UU. y Europa dirigidos por Jordy Bouwman de la Universidad de Colorado en Boulder, EE. UU., combinó experimentos sobre metilo y ortobencino en Swiss Light Source con simulaciones que ayudaron a identificar los productos probables de la combinación de los dos. compuestos.

El estudio reveló que la ortobencina puede desempeñar un papel importante en la química de TMC-1 ya que, como señala Shingledecker, “entre las especies cíclicas conocidas en TMC 1, puede producir fácilmente especies más complejas de manera muy eficiente”. Las reacciones que involucran ortobencino también explican la formación de indeno y posiblemente cianociclopentadienos que se han observado en TMC-1, así como otros hidrocarburos cíclicos y sustituidos con nitrógeno, lo que subraya la importancia que tendrían estas reacciones en las frías nubes moleculares interestelares.
En otros lugares, investigadores han ideado vías químicas para que se formen moléculas orgánicas de apariencia sorprendentemente biótica en estos entornos interestelares improbables. Kaiser y Agnes Chang de la Universidad Nacional Dong Hwa de Taiwán han dirigido varios estudios que analizan la posibilidad de diferentes reacciones químicas en el espacio interestelar gaseoso y también dentro de los hielos de nanopartículas interestelares.
Entre ellos estaba la combinación de dióxido de carbono y amoníaco para producir ácido carbámico, que es un ingrediente destacado en gran parte de la bioquímica, incluida la síntesis biológica de azúcar a partir de sales de carbamato en el ciclo de Calvin y la síntesis de las nucleobases que forman los nucleótidos y, en última instancia, los ácidos nucleicos. ácido en el ADN a partir de carbamoil fosfato. Ambas moléculas precursoras son probablemente candidatas a la química interestelar, ya que han sido detectadas en hielos interestelares y como base de Lewis, se esperaría que el amoníaco se combinara con el dióxido de carbono.
Para verificar qué podría formarse, los investigadores monitorearon los espectros infrarrojos de los dos químicos depositados sobre un sustrato a entre 5 y 10 K y calentados a 1 K por minuto.
Los espectros, junto con sofisticadas mediciones y cálculos de espectrometría de masas de fotoionización, indicaron que las reacciones comenzaron alrededor de 39K. En el hielo, de alguna manera, la barrera se contrae y es más fácil. Aunque la barrera inferior también hace que sea más fácil disociarse nuevamente en sus precursores, a medida que aumentan las temperaturas y la molécula se sublima del solvente, descubrieron que era lo suficientemente estable como para sobrevivir a las temperaturas más altas de las regiones de formación de estrellas donde también se pueden formar planetas.
El trabajo presenta un interesante escenario alternativo para los orígenes de las moléculas prebióticas que a menudo se considera que se formaron en la Tierra gracias a una sacudida de energía de un relámpago.
Kaiser también señala que, aunque la gente suele atribuir efectos de solvatación al agua, en el estudio de síntesis del ácido carbámico el disolvente es el amoníaco en la fase condensada (helada). Esto es muy interesante porque en la Tierra el amoníaco es bastante tóxico, pero en el espacio, el químico tóxico es realmente necesario para formar moléculas que posiblemente estén involucradas en el origen de la vida.
Aunque todavía no se han observado ácido carbámico ni su sal en una nube molecular como TMC-1 o en regiones de formación de estrellas como SgrB2, señalan Kaiser y Chang en su informe, es muy posible que telescopios como el telescopio espacial James Webb o el gran conjunto milimétrico de Atacama puedan detectarlos en futuros estudios.
Quedan otros misterios. Al comparar la abundancia relativa de azufre en el espacio y la abundancia de azufre en las moléculas que se han observado en las nubes moleculares parece haber una cantidad significativa ausente en las observaciones. El problema del azufre faltante ha despertado especial interés porque, las moléculas que contienen azufre son vitales para la vida. La sugerencia es que el azufre debe estar presente en formas indetectables como el S8, pero si bien se han propuesto teorías sobre cómo podría formarse en el espacio interestelar, hasta el momento no hay evidencia experimental concluyente al respecto.
La superposición entre las moléculas que se encuentran en el espacio y las que a menudo se consideran prebióticas o integrales para los procesos de vida aquí en la Tierra ha tentado a especular que provienen de formas de vida extraterrestres. En lugar de considerar las moléculas orgánicas observadas en diferentes tipos de nubes moleculares como desechos alienígenas, el trabajo de laboratorio y los cálculos teóricos revelan una procedencia más probable, y posiblemente más intrigante de todas estas sustancias, en la forma de una química interestelar sorprendentemente rica.
En ella, longitudes astronómicas de tiempo remodelan lo que, por lo general, podría denominarse como un encuentro probable en densidades tan bajas. Y si esa química puede dar lugar a vida en la Tierra, quién sabe adónde podría conducir en otros lugares.
GABRIELA PÉREZ AGUIRRE
Estudió ingeniería química en la Facultad de Química de la UNAM. Es autora de libros de texto de física y química a nivel secundaria y de química a nivel bachillerato. Colaboró en la concepción, desarrollo y edición de libros de texto, interactivos y guiones para la red EDUSAT, del Instituto Latinoamericano para la Comunicación Educativa (ILCE). Formó parte del equipo editorial de la Revista Ciencias, de la Facultad de Ciencias de la UNAM



