Carlos Naranjo Castañeda y Eusebio Juaristi
¿Sabías que un medicamento puede adoptar dos formas diferentes de la molécula que constituye el principio activo, una benéfica y otra potencialmente dañina?
Piensa en un medicamento, es decir, una sustancia que se administra para tratar una enfermedad o aliviar sus manifestaciones. Debes entonces considerar que dicho medicamento contiene un fármaco, que es la sustancia activa que produce el efecto terapéutico o de curación deseado, pero que en algunos casos está constituido por moléculas que, a primera vista, parecen ser similares, pero que en realidad actúan de manera potencialmente perjudicial en tu cuerpo.
Efectivamente, la quiralidad (término derivado de χέρι ‘queir’, mano en griego) es un fenómeno molecular que da lugar a que algunas moléculas presenten dos formas diferentes, cada una con un efecto específico en el cuerpo. En la medicina, esto puede significar la diferencia entre un tratamiento efectivo y uno peligroso como resultado de la actividad exhibida por la forma secundaria. Así pues, la estructura precisa de una molécula puede tener consecuencias cruciales para nuestra salud. En este artículo exploraremos cómo la quiralidad influye de manera determinante en el curso de acción de la medicina y por qué es fundamental tomarla en cuenta para desarrollar tratamientos médicos seguros y efectivos.

¿Qué es la quiralidad y por qué es importante en la medicina?
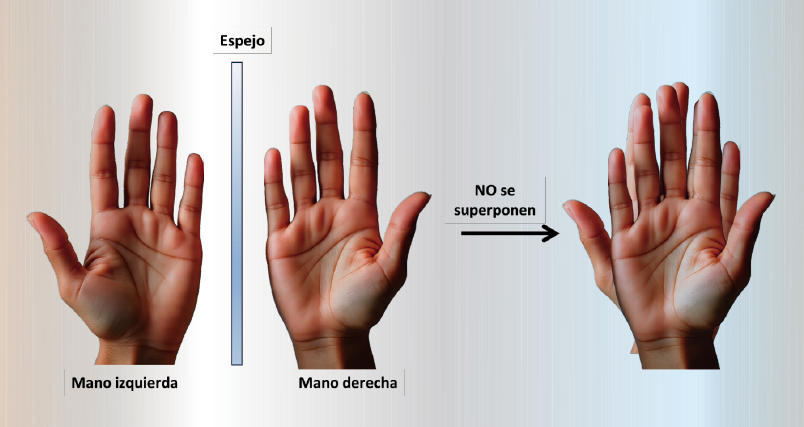
La quiralidad es un fenómeno fascinante que se puede apreciar en nuestro entorno, tanto en la naturaleza, como en muchos objetos creados por los seres humanos. Un ejemplo muy cercano a nosotros es la relación que existe entre nuestras manos: la mano izquierda y la mano derecha son similares, pero no son realmente iguales y, de hecho, no se pueden superponer correctamente. Esto se debe a que son imágenes que son reflejo una de la otra, como si estuvieran frente a un espejo.
En el mundo de la química farmacéutica ocurre algo similar: numerosos fármacos presentan una estructura, cuya “imagen de espejo” no se puede superponer con la estructura original. Estas moléculas se denominan enantiómeros, que, para fines prácticos, en especial para facilitar su identificación, se clasifican como el enantiómero R (del latín “rectus”, que significa “derecho”) y el enantiómero S (del latín “sinister”, que significa “izquierdo”).
En este contexto, el enantiómero responsable de la actividad curativa se denomina “eutómero”, mientras que su imagen de espejo pudiera ser inactivo o de plano tóxico, y se designa como “distómero”. Por cierto, estos términos fueron acuñados por el químico mexicano Pedro A. Lehmann, 1934-2003, con base en los prefijos griegos ‘eus’ que significa ‘bueno’ y ‘dis’, que significa ‘malo’.
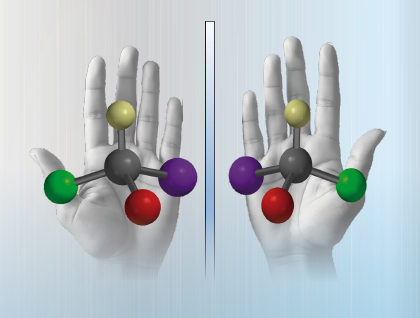
Cuando se combinan cantidades iguales del par de enantiómeros, se forma lo que se conoce como una “mezcla racémica”, que contiene ambas versiones de la molécula en una proporción 50:50. Cada enantiómero presenta su propia estructura, lo que puede afectar la manera cómo interactúan con otras moléculas en el cuerpo humano; en especial las biomoléculas, que también son quirales.
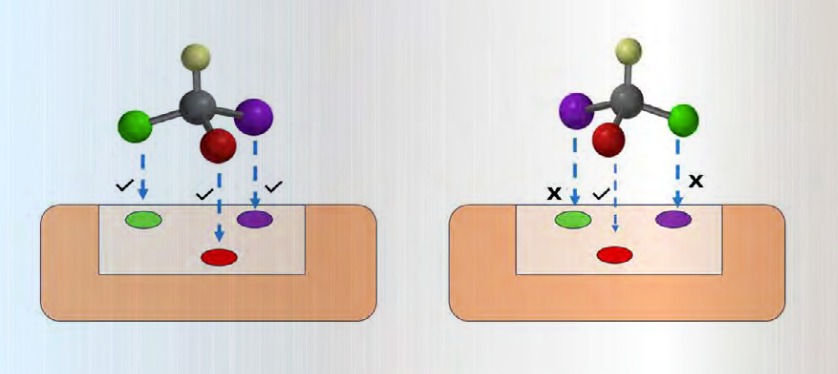
En este sentido, nuestro cuerpo cuenta con herramientas moleculares precisas, como son las proteínas, enzimas y receptores, que facilitan las reacciones bioquímicas vitales. Estas herramientas, conocidas como dianas farmacológicas, son el objetivo de los fármacos en el proceso de inducir un efecto farmacológico específico. Algo que es notable es que estas dianas son altamente selectivas, lo que significa que solo responden a moléculas con una estructura tridimensional específica; en particular, tienen respuesta ante uno de los enantiómeros (a esto se le denomina enantiodiferenciación).
Una analogía clara de esta selectividad son las enzimas, que funcionan como “cerraduras” que solo se abren con la “llave” complementaria. En este caso, la llave es el enantiómero (R o S) de un fármaco. Si la molécula no presenta la estructura correcta, el fármaco no será eficiente, o incluso puede provocar efectos secundarios perjudiciales, como se menciona adelante.
¿Qué sucede cuando un medicamento tiene una forma molecular incorrecta y se administra a miles de personas?
El resultado puede ser trágico. Un ejemplo que ilustra la gravedad del problema es el caso de la talidomida, un medicamento que se introdujo en 1957 como sedante y somnífero para mitigar las náuseas en mujeres embarazadas. Sin embargo, la talidomida resultó ser un desastre médico sin precedentes, ya que causó defectos congénitos graves y devastadores en decenas de miles de bebés recién nacidos, incluyendo malformaciones de brazos y piernas, daño cerebral y otros problemas de salud que cambiaron la vida de esas personas. La talidomida fue retirada del mercado en 1961, después de que se descubriera la terrible naturaleza de sus efectos secundarios.
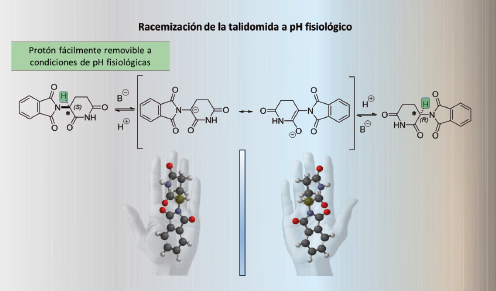
Efectivamente, la investigación posterior reveló que la tragedia se debió a la presencia de los dos enantiómeros (es decir, la mezcla racémica) en el fármaco que se comercializó y administró como tranquilizante. Una de estas formas, el eutómero R, resulta efectivo para aliviar las náuseas, mientras que el otro, el distómero S, es dañino y causa los defectos congénitos mencionados. Esto significa que, aunque una de las formas del medicamento presenta un efecto beneficioso, la otra forma provoca un daño irreparable a los fetos en desarrollo.
Surge una pregunta, ¿pudo haberse evitado esta tragedia si se hubiera comercializado únicamente el eutómero en vez de la mezcla racémica del eutómero y el distómero?
Desafortunadamente, la respuesta es más compleja de lo que se esperaba: los enantiómeros de la talidomida se interconvierten in vivo, lo que significa que incluso si se hubiera administrado únicamente la forma molecular deseada de la talidomida, la otra forma enantiomérica se hubiera generado en el cuerpo humano como consecuencia de las reacciones químicas naturales que ocurren espontáneamente en nuestro organismo.
Este fenómeno se conoce como epimerización de moléculas quirales y puede representar un gran obstáculo en el desarrollo de fármacos. El proceso de epimerización significa que las moléculas de algunos fármacos como la talidomida pueden cambiar de la estructura quiral dentro del organismo humano, conduciendo a la forma indeseada, lo que puede afectar su eficacia y confiabilidad. A este proceso se le llama también racemización, y ocurre cuando los enantiómeros de un fármaco se convierten en su forma opuesta como consecuencia de su reactividad química.
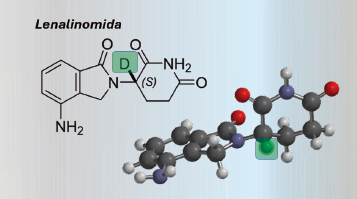
La lenalidomida es otro fármaco que, al igual que la talidomida, experimenta la racemización in vivo, lo que puede afectar su eficacia y confiabilidad. Cabe señalar que los científicos han desarrollado estrategias innovadoras para evitar esta racemización. Una de ellas es la técnica de Interruptores Quirales Habilitados con Deuterio (DECS, por sus siglas en inglés), que utiliza un átomo especial, el deuterio, un isótopo del hidrógeno más pesado que el hidrógeno normal. Al incorporar el átomo más pesado en la molécula del fármaco, se “bloquea” la reactividad del enantiómero deseado (el eutómero), evitando que se convierta en el distómero, lo que permite preservar la quiralidad del fármaco y asegurar que funcione de manera efectiva y segura.
Como puedes ver, el caso tan dramático observado en la talidomida destacó lo importante que es entender que los enantiómeros de un fármaco quiral pueden presentar efectos drásticamente diferentes en el cuerpo humano. A raíz de este incidente, la industria farmacéutica y los organismos reguladores de la producción de fármacos cambiaron significativamente su enfoque hacia la importancia de la pureza enantiomérica en los medicamentos quirales. Aquí resulta pertinente recordar a pioneros como el profesor E. J. Ariëns, que jugaron un papel fundamental al impulsar la idea de desarrollar fármacos con una sola estructura quiral a fin de tener certidumbre sobre la eficacia de los tratamientos.
Inexplicablemente, a pesar de la importancia que representa utilizar fármacos enantiopuros en la química farmacéutica, muchos fármacos quirales siguen siendo administrados como mezclas racémicas. Esto se debe a que, en algunos casos, la mezcla de enantiómeros puede ser beneficiosa para el tratamiento de ciertas enfermedades. Sin embargo, en otros casos, la falta de comprensión de los mecanismos de unión entre los fármacos y los receptores biológicos, así como la dificultad técnica de producir los enantiómeros puros, pueden desalentar el desarrollo de metodologías para la síntesis enantioselectiva de los fármacos quirales en la industria farmacéutica.
¿Cuáles son las ventajas y desventajas de utilizar la forma enantiopura en lugar de la mezcla racémica en términos de eficacia y seguridad?
Uso de enantiómeros puros
El empleo de enantiómeros puros en el tratamiento de una enfermedad ofrece beneficios significativos, entre los que destaca el hecho de que, generalmente, presentan una mayor actividad farmacológica. Asimismo, por su mayor efectividad farmacológica, se reduce el riesgo de efectos secundarios, lo que facilita la dosificación y el seguimiento del tratamiento médico. Además, una mayor efectividad del medicamento facilita determinar cómo se absorbe, distribuye, metaboliza y elimina del organismo. Esto puede aumentar el éxito de los tratamientos médicos, lo que representa un impacto positivo en la salud y el bienestar de los pacientes.
Sin embargo, también existen algunas desventajas en utilizar un solo enantiómero. En primer lugar, la producción de formas enantioméricamente puras suele ser más costosa que la producción de mezclas racémicas de los fármacos quirales. Además, la síntesis química de fármacos enantiopuros puede ser más compleja y requerir, por lo tanto, procedimientos y técnicas más sofisticadas, que pudieran estar fuera del alcance de los desarrolladores farmacéuticos.
Uso de la mezcla racémica
Una mezcla racémica puede tener diversas ventajas, como es un menor costo de producción y una mayor simplicidad de la síntesis química involucrada. Cabe señalar, sin embargo, que en algunos casos los enantiómeros en una mezcla racémica pueden trabajar juntos para producir un efecto más potente, mediante lo que se conoce como sinergia farmacológica.
No obstante, en el uso de mezclas racémicas de un fármaco quiral también se presentan desventajas significativas. En primer lugar, el fármaco puede tener una menor eficacia debido a la menor actividad farmacológica de uno de los enantiómeros (el distómero), lo que contrarresta la efectividad proporcionada por el eutómero. Además, una mezcla racémica puede presentar efectos tóxicos secundarios y, por lo tanto, ser menos segura. También puede tener un perfil farmacocinético menos predecible, lo que puede dificultar la dosificación y el seguimiento del tratamiento en el paciente.
¿Qué determina el uso de un enantiómero puro o la mezcla racémica de un medicamento quiral?
La elección entre emplear fármacos racémicos o enantiómeros puros es un tema crucial en el desarrollo de medicamentos quirales. La mayoría de los fármacos en uso hoy en día son compuestos quirales y, sorprendentemente, cerca del 90% de ellos se comercializan como racematos. Pero, ¿qué significa esto para la eficacia y seguridad de los tratamientos? La clave está en entender cómo interactúan los fármacos con sus dianas farmacológicas. Por lo tanto, no hay una respuesta única para todos los casos, y cada fármaco debe ser evaluado individualmente para determinar si la utilización de un solo enantiómero ofrece ventajas significativas en términos de eficacia y seguridad, o si la mezcla racémica es suficiente para lograr los resultados deseados.
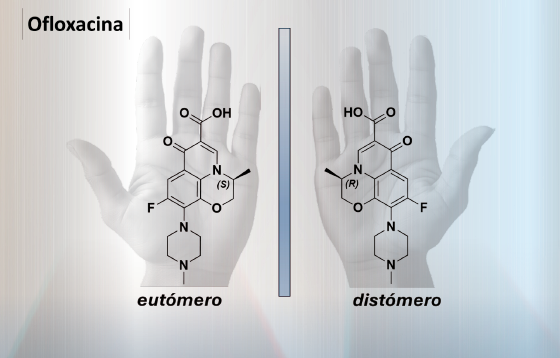
Un ejemplo que ilustra la importancia de la quiralidad en la eficacia de los fármacos es el antibiótico ofloxacina. La ofloxacina actúa inhibiendo la enzima ADN girasa bacteriana, que es crucial para la replicación y supervivencia de las bacterias que causan infecciones en el cuerpo humano. Investigaciones recientes han demostrado que el enantiómero S de la ofloxacina es significativamente más efectivo que el enantiómero R o la mezcla racémica, ya que se une con mayor afinidad a la enzima ADN girasa bacteriana. Esta unión más fuerte resulta en una inhibición más efectiva de la enzima, lo que a su vez potencia la acción antibacteriana del fármaco, mejorando su capacidad para eliminar las bacterias patógenas.
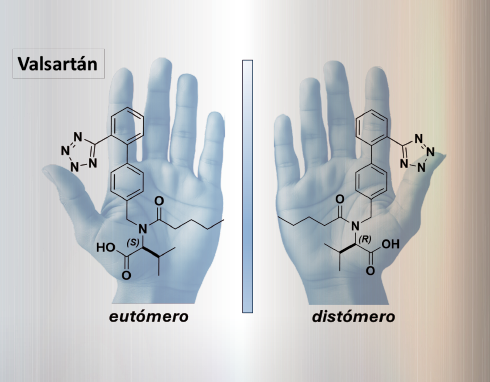
Un ejemplo adicional es el valsartán, un medicamento ampliamente utilizado para tratar la hipertensión arterial. El valsartán ejerce su efecto terapéutico bloqueando específicamente el receptor de la angiotensina II, que es una enzima que provoca vasoconstricción, aumentando la presión arterial. Algo que es particularmente interesante es que solo el enantiómero S es responsable de la actividad farmacológica deseada, es decir, del bloqueo del receptor de la angiotensina II y la consiguiente reducción de la presión arterial. Por otro lado, el enantiómero R no muestra actividad farmacológica significativa, lo que subraya la importancia de la quiralidad en la interacción entre el fármaco y su receptor biológico, que también es quiral.
¿En qué casos es el uso de fármacos quirales racémicos más beneficioso que el uso de sus enantiómeros individuales?
Aunque idealmente es mandatorio desarrollar fármacos enantiopuros, hay casos en los que el empleo de la mezcla racémica puede ser más benéfico.
Por ejemplo, el estudio del tramadol, un medicamento opiáceo utilizado para quitar el dolor, resultó en un descubrimiento sorprendente: si bien es sabido que los opiáceos son poderosos analgésicos, también es un hecho que conllevan un riesgo significativo de adicción. Sin embargo, sorprendentemente en el caso del tramadol se ha encontrado que la mezcla racémica no solo alivia el dolor, sino que también ¡reduce el riesgo de adicción! Esta observación es muy importante, ya que la adicción a los opiáceos es un problema devastador que puede llevar a una dependencia física y psicológica, e incluso a la muerte. La mezcla de enantiómeros en el tramadol ofrece una esperanza para aquellos pacientes que tienen necesidad de un tratamiento para el dolor, pero tienen el temor justificado de caer en las garras de una adicción.
Relevancia que la quiralidad de un fármaco tiene para el futuro de la medicina
En un mundo en constante cambio, donde las enfermedades evolucionan y aparecen nuevos retos en el área de la salud, el desarrollo de nuevos fármacos es decisivo. Además de la innovación en nuevas terapias farmacológicas, los fármacos ya consolidados pueden ser el punto de partida para el descubrimiento de futuras medicinas, por lo que es fundamental tomar en cuenta su quiralidad.
La experiencia reciente con la pandemia de COVID-19 ha puesto de manifiesto la importancia de comprender el papel que la quiralidad de los fármacos juega, incluso en aquellos medicamentos ya establecidos. El caso de la cloroquina (CQ) y la hidroxicloroquina (HCQ) es un ejemplo alarmante de cómo la falta de comprensión de la quiralidad molecular puede tener consecuencias graves. Durante la pandemia de 2019, la CQ y la HCQ se administraron como mezclas racémicas a pacientes hospitalizados, a pesar de que se habían reportado riesgos de toxicidad cardíaca, hepática y retiniana, asociados con los enantiómeros individuales. Esta situación generó un debate intenso sobre la conveniencia de su uso, lo que llevó a la suspensión de su administración a pacientes. Sin embargo, la falta de información precisa sobre la actividad de los enantiómeros individuales dejaba pendiente la tarea de tomar en consideración la quiralidad molecular en el desarrollo y uso de la CQ y la HCQ.
La historia de la talidomida y de muchos fármacos quirales que están disponibles en el mercado nos enseña que la elección razonada del eutómero en fármacos quirales puede ser una cuestión de vida o muerte. La clave para evitar tragedias y desarrollar medicamentos efectivos y seguros consiste en entender el mecanismo de unión entre los fármacos y sus dianas farmacológicas, que también son quirales. Solo mediante una comprensión adecuada de la quiralidad molecular podemos asegurarnos de que los fármacos sean diseñados y utilizados de manera que maximicen su eficacia y minimicen riesgos potenciales de su uso.
Lecturas recomendadas:
Juaristi, E. “Introducción a la Estereoquímica y al Análisis Conformacional”, El Colegio Nacional, Ciudad de México, 2007. Edición electrónica: El Colegio Nacional: Ciudad de México, 2024.
https://libroscolnal.com/cdn/shop/files/[email protected]?v=1710455889
Peng, S.; Zhu, Y.; Luo, C.; Zhang, P.; Wang, F.; Li, R.; Lin, G.; Zhang, J. “Chiral drugs: Sources, absolute configuration identification, pharmacological applications, and future research trends”. LMD 2024, 1, 100008.
Ceramella, J.; Iacopetta, D.; Franchini, A.; De Luca, M.; Saturnino, C.; Andreu, I.; Sinicropi, M.S.; Catalano A. “A Look at the Importance of Chirality in Drug Activity: Some Significative Examples”. Appl. Sci. 2022,12, 10909.
Naranjo-Castañeda, C.; García-Revilla, M.A.; Juaristi, E. “A New In Silico Comparison of the Relative Affinity of Enantiomeric Chloroquine (CQ) and Hydroxychloroquine (HCQ) for ACE2”. Pharmaceuticals 2025, 18, 982.
Carlos Naranjo Castañeda
Alumno de doctorado del departamento de Química en el Centro de Investigación y de Estudios Avanzados (Cinvestav).
Eusebio Juaristi
Profesor–investigador titular de dicho departamento, pertenece a El Colegio Nacional.



