José Manuel Sánchez Ron*
No son pocas las leyes científicas importantes, aunque menos aquellas con las que todo estudiante de enseñanza media debería estar familiarizado, casi recitarlas de memoria.

El teorema de Pitágoras sobre las relaciones de los lados de un triángulo rectángulo, las tres leyes del movimiento y la ley de la gravitación universal de Newton, o el emparejamiento que se da entre las bases que componen el ADN (adenina con timina, guanina con citosina), conocido como Ley de Chargaff, vienen inmediatamente a la mente.
Pero existe otra ley que también forma parte de este exclusivo club: la que subyace en la Tabla Periódica de los elementos químicos, Tabla que siempre quedará asociada al nombre del químico ruso Dmitri Ivanovitch Mendeléiev (1834-1907). Fue en marzo de 1869 cuando Mendeléiev presentó a la Sociedad Rusa de Química la primera versión de una tabla, que mejoró posteriormente (cambiando filas por columnas en su ordenación), en la que organizaba los 63 elementos químicos por entonces conocidos basándose en sus propiedades químicas.
Desentrañar la génesis de un descubrimiento científico suele ser tarea incierta, tantos son los factores que pueden intervenir en la mente del creador. Mendeléiev no es una excepción, pero en el caso de la Tabla Periódica es posible identificar algunas circunstancias que influyeron en el proceso que le condujo a ella, circunstancias que tienen que ver con su biografía.

Nacido en Siberia, ciertamente no el mejor de los lugares entonces para estudiar una carrera científica, Mendeléiev estudió en el Instituto de Pedagogía de San Petersburgo (la Universidad de esa ciudad no lo aceptó; por su origen, como tampoco lo había hecho antes la de Moscú), destacando lo suficiente como para que el gobierno le concediese una beca para ampliar sus estudios de química en Heidelberg (Alemania). Allí, en 1859, consiguió un puesto en el laboratorio del famoso químico Robert Bunsen, pero lo importante es que tuvo la oportunidad de participar en un congreso – el primero de carácter internacional en la historia de la Química – que se celebró en septiembre de 1860 en Karlsruhe, al que asistieron 140 químicos de todo el mundo, entre ellos los más destacados del mundo, para tratar de clarificar nociones básicas de la química pero que, sin embargo, estaban sumidas en la confusión.
En 1861, regresó a San Petersburgo donde en octubre de 1867 obtuvo una cátedra de Química en la Universidad. Y este es el, o uno de los puntos clave, para comprender cómo llegó a la Tabla Periódica. Uno de los cursos cuya enseñanza tuvo que asumir fue el de Química Inorgánica, que seguía una gran cantidad de alumnos pues era obligatorio para todos los estudiantes de la Facultad de Ciencias Naturales.
Para facilitar su tarea, Mendeléiev buscó algún libro que pudieran utilizar los alumnos, pero no encontró ninguno en ruso: todos eran anticuados, y desde luego ninguno que incorporase desarrollos recientes como los que habían provocado la reunión de Karlsruhe, y tampoco contaban con capítulos sobre apartados como las técnicas de espectroscopía, o los nuevos elementos químicos descubiertos.
Se puso entonces a escribir él mismo un libro de texto. Inmerso en este trabajo, en enero de 1869 se dio cuenta de que tenía un serio problema: había enviado a la imprenta el primer volumen de lo que sería su libro Osnov khimii (Principios de Química), estaba contento con cómo lo estaba desarrollando, pero aquel tomo únicamente trataba de ocho elementos químicos; quedaban, por consiguiente, cincuenta y cinco por presentar en el segundo volumen previsto.
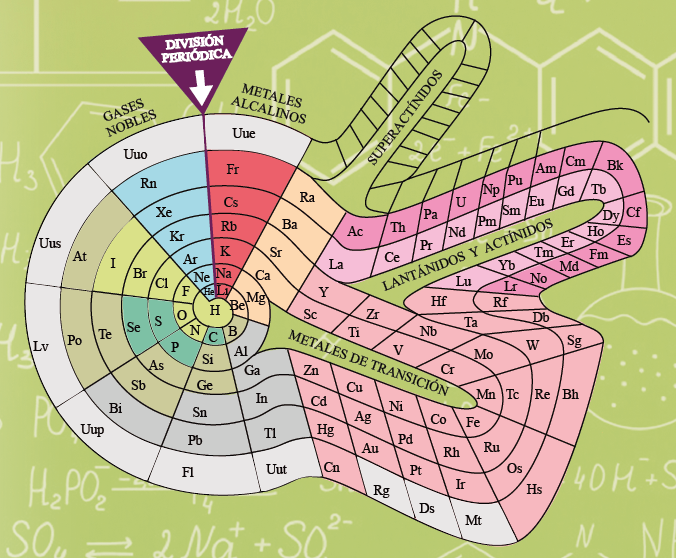
Claramente, necesitaba algún principio organizador de los elementos químicos que le permitiera simplificar la discusión. Esto es lo que le llevó a la Tabla Periódica de los elementos.
La necesidad de disponer de semejante organización la habían sentido otros antes que él: en 1864, el químico inglés John Alexander Newlands descubrió que cuando se colocaban los elementos siguiendo el orden de sus pesos atómicos, a partir del octavo elemento los ocho siguientes mostraban propiedades muy similares a los ocho anteriores (“ley de las octavas”).
Esto representó el primer reconocimiento del principio de periodicidad en la serie de los pesos atómicos, pero la comunidad química no apreció el resultado y Newlands no intentó desarrollarlo más. En el curso de sus esfuerzos por encontrar un principio unificador para su tratado químico, Mendeléiev se dio cuenta también de este hecho y, con la decisión de un revolucionario, resolvió algunos problemas que aparecían inmediatamente: el orden en cuestión se rompía en ocasiones y para evitarlo incluyó cuatro “huecos” (con el símbolo “?”) para restaurarlo.
La idea que subyacía era que debían existir algunos elementos aún desconocidos. En 1871, predijo la existencia de tres de esos elementos, llegando a señalar sus propiedades más destacadas (incluyendo el peso atómico aproximado). Estas predicciones se vieron confirmadas pronto: en 1875, el francés Paul de Boisbaudran anunciaba el descubrimiento del galio (ekaboro para Mendeleiev); en 1879, el sueco Lars Nilson hacía lo propio con el escandio (ekaluminio), y en 1886 el alemán Clemens Winkler descubría el germanio (ekasilicio)
Los nombres que acabo de mencionar ya revelan algo de lo mucho que esconde la Tabla Periódica. Ésta es, por supuesto, expresión de una ley general de la naturaleza, la del orden que existe en los elementos químicos (se conocen en la actualidad 118, aunque se está trabajando para “fabricar” los números 119 y 120), una ley que Mendeléiev descubrió a partir del conocimiento empírico de las propiedades de esos elementos y que en la década de 1920 Niels Bohr explicó en términos de su composición atómica, pero esta tabla maravillosa aporta también otras cosas. Los nombres de sus elementos esconden una geografía, científica pero también política, de la química.
Lo diré una vez más, imitando a Pasteur: “la ciencia no tiene patria, pero los científicos sí”. Consecuentemente, detrás de cada cuadrado de esa Tabla – el “hogar” de cada uno de los elementos – se pueden encontrar historias magníficas. Encontrarlas o imaginarlas. Como hizo el inolvidable Primo Levi en su El sistema periódico.
Por cierto, la Academia Sueca de Ciencias no consideró a Mendeléíev digno de recibir el Premio Nobel de Química, que se concedió por primera vez en 1901. O si lo consideró (fueron muchas las propuestas en su favor), espero demasiado.

La difusión de la Tabla Periódica: el caso de España
Uno de los problemas clásicos que se estudian en la historia de la ciencia es el de la recepción de las teorías que surgen en la ciencia. Yo mismo, por ejemplo, me he ocupado con cierta extensión de la recepción de las teorías especial y general de la relatividad en el Reino Unido entre físicos, matemáticos y filósofos.
En el caso de la Tabla Periódica existe un libro dedicado a cómo fue recibida en diversos países: Early Responses to the Periodic System, editado por Masanori Kaji, Helge Kragh y Gäbor Palló (Oxford University Press, 2015). Y en uno de mis libros, El país de los sueños perdidos. Historia de la ciencia en España (Taurus, 2020) me ocupé brevemente de su recepción España, que tal vez tenga algún interés en esta ocasión.
- Se conocen en el día 38 metales, que hemos expresado ya en la lista de los cuerpos simples, y también en nuestro plan de estudio. Seis de estos no se han podido obtener aun en estado metálico, y solo están admitidos en el número de los metales por analogía, en razón de que las materias de que se extraen tienen mucha relación con los oxides metálicos. Estos seis supuestos metales son el silicio, el zirconio, el aluminio, e1 itrio, el glucinio y el magnesio.”
El criterio de clasificación era, como vemos, la reactividad de los metales con el oxígeno, a la que también añadió el agua.
Si se busca en libros de texto, el primero en el que se mencionaba la tabla periódica de Mendeléiev fue el de Santiago Bonilla Mirat, catedrático de Química en la Universidad de Valladolid: Tratado elemental de química (1880). Cuando, ya en la década de 1890, Bonilla consiguió la cátedra de Química de la Universidad Central en Madrid, su libro aumentó su influencia siendo reeditado varias veces. En el capítulo sobre el atomismo químico, se mencionaba el reciente descubrimiento del escandio como prueba de la “gran importancia” de las ideas de Mendeléiev.
La consolidación real de la inclusión de la tabla de Mendeléiev en los libros de texto de química que se manejaban en España tuvo lugar una vez que se comprobó la exactitud de las predicciones del químico ruso con respecto a la existencia de nuevos elementos químicos, en concreto, del galio (1875) y, como he apuntado en el caso de Bonilla, del escandio (1879).

Aun así, no parece que la tabla fuese apreciada como una de las piezas maestras para desentrañar la composición material del universo; esto es, al menos, lo que Blas Cabrera, el físico más notable de España entonces, director del mejor centro de investigación español en física y química-física, el madrileño Laboratorio de Investigaciones Físicas, afirmaba en su discurso de contestación al de Ángel del Campo (1927), cuando este leyó el suyo de entrada en la Real Academia de Ciencias Exactas, Físicas y Naturales, dedicado, precisamente, al “Sistema periódico de los elementos”:
“Hacia los últimos años del pasado siglo, cuando el señor del Campo y yo asistíamos a las aulas de nuestra Universidad, la obra de Mendelejeff no era estimada generalmente en más que una acertada disposición de los elementos para recordar, y prever en su caso, las propiedades que los caracterizan.” Pero en 1927 aquel tiempo ya había, felizmente, pasado.



