Carmina de la Luz*
El 22 de marzo de 2016, un grupo terrorista hizo estallar dos bombas en el aeropuerto internacional Zaventem de Bruselas. Varias personas murieron y decenas resultaron heridas. Entre ellas se encontraba Karen Northshield, una entrenadora física belga de 30 años, cuyas lesiones eran tan graves que su corazón se detuvo.
Por fortuna, los médicos lograron reanimarla en el hospital. Ahí tuvieron que amputarle parte de la cadera y del estómago; le extirparon el bazo y le hicieron varios autotrasplantes de tejido para reparar el daño. Pero justo cuando la situación parecía bajo control, inició otro infierno: una variedad súper resistente de la bacteria Klebsiella pneumoniae había infectado a Karen y no reaccionaba a ningún tratamiento.
Veintitrés meses después del atentado, la batalla campal de Karen y los médicos contra el microbio seguía, hasta que una alternativa experimental les dio tregua. Sin embargo, no todos corren con la misma suerte. Un estudio publicado por la revista especializada, The Lancet, a principios de 2022, estima que 1.2 millones de pacientes pierden la vida anualmente a causa de las superbacterias. Estas surgen debido al uso indiscriminado y descuidado de los antibióticos -tanto en humanos como en el ganado- a partir de la segunda mitad del siglo XX. Es tal la magnitud del problema que para 2050 podría significar la muerte de 10 millones de personas (o sea, tres veces más decesos que los que dejó la pandemia por COVID-19 en 2020). Para evitar dicho escenario apocalíptico, una investigadora octagenaria busca incansablemente nuevas opciones de fármacos. Se trata de Ada Yonath, premio Nobel de Química 2009 y directora del Helen and Milton A. Kimmelman Center for Biomolecular Structure and Assembly del Instituto Weizmann, en Israel.

Ada nació en Jerusalén el 22 de junio de 1939. Sus padres -Hillel y Esther Lifshitz- eran inmigrantes polacos judíos, con recursos tan limitados que debían compartir un departamento de solo cuatro habitaciones con otras dos familias. Fue en ese pequeño rincón del mundo donde Ada llevó a cabo el primer experimento que develaría su espíritu científico. Tenía apenas cinco años de edad. “Quise medir la altura del techo de nuestra casa (…) fui al balcón, amontoné muebles, una mesa, sillas, sin poder llegar al techo. Quise subirme a la pila, pero me caí en el patio y me rompí un brazo”, ha contado la propia Yonath, quien pese al accidente continuó indagando en cómo funcionan las cosas.
1950 fue un año difícil, pues su padre falleció y ella buscó trabajo para ayudar a Esther. Tuvo toda clase de empleos: lavaplatos, niñera, daba asesoría particular a niños más pequeños, y al mismo tiempo en la escuela destacaba como una extraordinaria alumna, admiradora de madame Curie. Hizo estudios profesionales de química, bioquímica y biofísica. Luego se especializó en cristalografía de rayos X. A finales de los 70s, Ada era una joven doctora del Instituto Weizmann decidida a resolver, mediante esa técnica, una de las principales incógnitas de las ciencias de la vida: la biosíntesis de proteínas. Y para ello era necesario descubrir la estructura de un escurridizo orgánulo, el ribosoma.
Dentro de las células hay ADN, una suerte de instructivo para cada organismo (sea humano, bacteria, planta, hongo, etcétera) y, a la vez, una molécula bastante pasiva. De no ser por los ribosomas -que ponen en acción esas instrucciones- básicamente no habría vida; son ellos quienes traducen la información del ADN en proteínas. La hemoglobina que transporta el oxígeno en la sangre, los anticuerpos que nos defienden de virus, el colágeno que le da firmeza a nuestra piel y hormonas como la insulina son ejemplos de proteínas. En el cuerpo humano existen decenas de miles de sustancias de este tipo, las cuales construyen y controlan la vida a nivel químico. Todas son fabricadas por los ribosomas.
El reto para Ada Yonath -que ella misma comparó con escalar el Everest- fue cristalizar esas diminutas maquinarias: “Su estructura es extraordinariamente intrincada; es inusualmente flexible, inestable y carece de simetría interna, todo lo cual hace que sea una tarea extremadamente formidable”. Además, los cristales que obtenía no resistían los rayos X. Por lo tanto, eran inobservables.
Ada encontró la solución mientras leía sobre los osos polares. Estos animales poseen ribosomas capaces de empaquetarse en las células de manera ordenada justo antes de la hibernación, y así permanecen intactos y funcionales durante meses. A la científica se le ocurrió entonces trabajar con ribosomas de organismos que viven en condiciones extremas. En el camino, Ada y su equipo desarrollaron la crio-bio-cristalografía (su mayor contribución a la ciencia, según narra ella), el método que les permitió ver las dos subunidades que constituyen al ribosoma en todo su esplendor tridimensional. Habían pasado décadas desde que Yonath decidió subir la montaña.
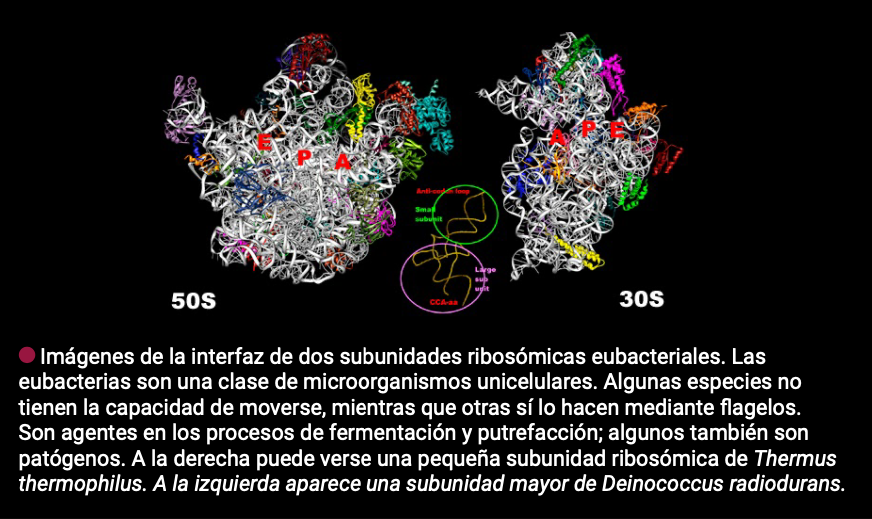
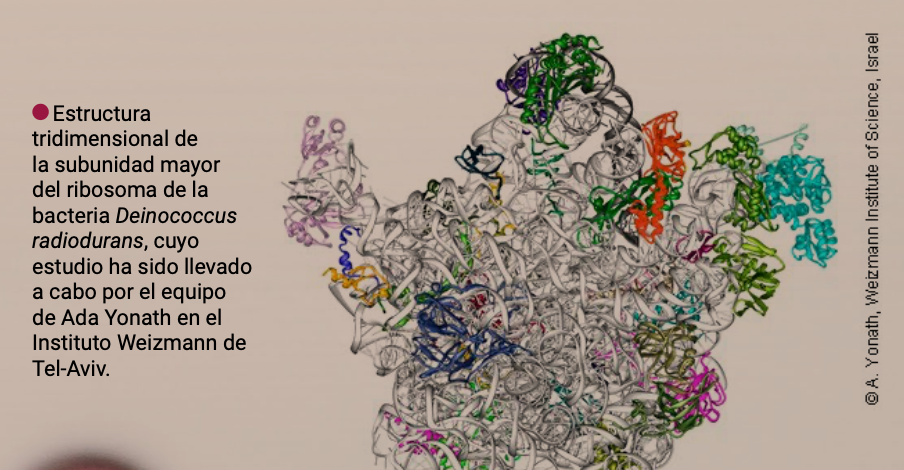
Pero ¿qué tiene que ver todo esto con los antibióticos? Un año después de publicar los hallazgos que le valieron el Nobel -compartido con los científicos Thomas A. Steitz y Venkatraman Ramakrishnan- el laboratorio de Ada concluyó que algunos antibióticos eliminan a las bacterias uniéndose a sus ribosomas e impidiendo que estos fabriquen proteínas. Hoy en día el grupo de Yonath busca blancos ribosomales que se traduzcan en una nueva generación de antibióticos: “muy específicos para cada patógeno, incluso para cada cepa, que sean absolutamente biodegradables, de tal manera que no contaminen. Y que sepan distinguir entre bacterias dañinas y las que no lo son (…) no es fácil, pero es lo que estamos haciendo”, confiesa la científica.




